Hypoparathyroïdie : « Enfin un changement de paradigme pour améliorer la qualité de vie »
Mal connue du grand public et longtemps minimisée par les professionnels de santé, l’hypoparathyroïdie est pourtant à l’origine de troubles fonctionnels majeurs chez les patients, allant de simples paresthésies à des crises de tétanie invalidantes. Encore récemment limitée à un traitement par calcium et vitamine D, la pathologie entre désormais dans une ère de substitution hormonale, grâce à l’arrivée du Palopegtériparatide. À l’hôpital de la Pitié-Salpêtrière, le Dr Cécile Ghander suit quotidiennement ces patients souvent en errance thérapeutique. Dans cet entretien exclusif, Dr Ghander revient sur la physiopathologie de la maladie, les pièges diagnostiques, les espoirs thérapeutiques et le rôle clé que peuvent jouer les pharmaciens dans l’accompagnement des patients.
La prise en charge de l’hypoparathyroïdie entre dans une nouvelle ère. Longtemps cantonnée à une supplémentation incomplète par calcium et vitamine D, cette maladie endocrinienne rare restait dans l’ombre, méconnue des soignants comme des patients. Avec l’arrivée récente d’un traitement substitutif innovant — le Palopegtériparatide — une opportunité se dessine enfin pour restaurer une calcémie stable et améliorer significativement la qualité de vie. Pour décrypter cette pathologie, sa physiopathologie, ses symptômes souvent méconnus, les pièges diagnostiques et les nouvelles perspectives thérapeutiques, nous avons rencontré le docteur Cécile Ghander, endocrinologue à la Pitié-Salpêtrière.
Quelles sont les bases anatomiques et physiologiques des glandes parathyroïdes ?
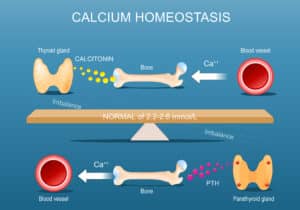
Dr Cécile Ghander : Les glandes parathyroïdes sont quatre petites structures, de la taille d’un pépin de pastèque, situées en arrière des lobes thyroïdiens. Bien qu’anatomiquement proches, elles n’ont aucun lien physiologique avec la thyroïde. Elles sécrètent une hormone, la parathormone (PTH), qui agit sur trois organes cibles — les os, le rein et le tube digestif — pour maintenir une calcémie normale. La PTH augmente le calcium sanguin, favorise l’excrétion rénale de phosphate et limite les pertes urinaires de calcium. Sa sécrétion est stable et s’adapte en continu aux besoins de l’organisme.
Comment définir l’hypoparathyroïdie et quelles en sont les causes ?
Dr C. G. : Il s’agit d’une insuffisance de sécrétion de PTH, ne permettant plus de maintenir une calcémie normale. Devant une hypocalcémie, on retrouve une PTH soit effondrée, soit inadaptée (normale, mais insuffisante au regard du contexte). Environ 80 % des cas sont post-chirurgicaux, suite à une thyroïdectomie totale où les glandes ont été lésées ou dévascularisées. Les 20 % restants relèvent de causes génétiques, auto-immunes ou idiopathiques.
Est-il possible de prévenir cette complication post-opératoire ?
Dr C. G. : Absolument. La prévention repose d’abord sur la limitation des thyroïdectomies totales quand elles ne sont pas indispensables. Par exemple, et selon les dernières recommandations de la société française d’endocrinologie sur la prise en charge des nodules thyroïdiens, il est possible de faire une lobectomie, y compris pour certains cancers de moins de 2 cm. Il est également possible de proposer la surveillance active des micro-cancers ou l’utilisation de la thermoablation (radiofréquence) pour les volumineux nodules thyroïdiens bénins et symptomatiques. À la Pitié, nous travaillons à une vraie désescalade chirurgicale. Il est par ailleurs fondamental de sensibiliser les prescripteurs — médecins traitants, endocrinologues, chirurgiens — sur ces alternatives, car trop souvent le patient ignore qu’il aurait pu éviter une ablation totale.
Quels sont les signes cliniques typiques de la maladie ?
Dr C. G. : Ils sont souvent trompeurs : fatigue intense, paresthésies (fourmillements), crampes, sensation de « batterie vide », brouillard cognitif, anxiété, troubles de la concentration, crises de tétanie. Certains patients décrivent une impossibilité à gérer leur charge mentale, ou à maintenir un effort, comme traverser une plage et ne pas pouvoir revenir.
Ces symptômes sont parfois minimisés, en particulier chez les femmes : la maladie étant invisible, fréquemment, elles ne sont pas entendues dans leur plainte, à la fois par les proches, mais aussi par le corps médical, fréquemment peu au courant de l’étendue de l’atteinte de la qualité de vie.
Sur le plan biologique, quels marqueurs recherchez-vous ?
Dr C. G. : Le diagnostic repose sur une calcémie basse avec une PTH inappropriée. Cette PTH peut être effondrée, ou faussement normale, mais inadaptée au contexte hypocalcémique. On observe également une hyperphosphatémie. D’autres marqueurs comme le dosage de la vitamine D active, le phosphate urinaire ou la calciurie peuvent être utiles pour affiner le suivi. Il faut toujours interpréter la PTH en lien avec la calcémie, jamais isolément.
Pourquoi le traitement conventionnel est-il souvent insatisfaisant ?
Dr C. G. : Il repose sur l’apport exogène de calcium et de vitamine D, avec notamment le cholécalciférol et l’alfacalcidol (Un-Alpha©). Cette approche ne permet pas de mimer la sécrétion stable et régulée de la PTH. On observe des fluctuations importantes de la calcémie, une complexité de traitement avec des prises nombreuses et fractionnées, et surtout une qualité de vie très altérée chez certains patients. En cas de bypass digestif, l’absorption est encore plus problématique.
Quels risques ou complications observe-t-on dans cette stratégie classique ?
Dr C. G. : On voit souvent des calcifications tissulaires, de l’hypercalciurie, des calculs rénaux… mais aussi un inconfort permanent lié aux symptômes persistants. Certains patients nécessitent jusqu’à 12 g de calcium par jour sans réussir à atteindre une calcémie correcte. Le traitement est lourd, avec souvent des effets secondaires digestifs, et l’adhésion thérapeutique devient très difficile.
Comment le tériparatide a-t-il été utilisé dans cette indication ?
Dr C. G. : Utilisé hors AMM depuis une vingtaine d’années, le tériparatide (Forsteo©), prescrit initialement dans l’ostéoporose, a permis d’améliorer la qualité de vie de certains patients avec hypoparathyroïdie. Il a été administré soit en injection quotidienne, soit en perfusion continue via pompe (comme dans le diabète) pour imiter au mieux la sécrétion physiologique de la PTH. Mais cette approche restait lourde, coûteuse et mal remboursée.
Quel changement représente l’arrivée du palopegtériparatide ?
Dr C. G. : C’est un tournant. Depuis octobre 2024, ce nouveau médicament (Yorvipath©) bénéficie d’un accès précoce avec AMM. Il offre une diffusion stable et prolongée de l’hormone, mimant la physiologie naturelle, sans pic ni creux. Environ 250 patients ont déjà été traités en France avec des résultats très encourageants. Il permet un véritable retour à une vie normale pour des patients jusque-là très limités dans leurs activités.
La qualité de vie est donc devenue un objectif thérapeutique ?
Dr C. G. : Tout à fait. C’est même devenu un objectif central, au même titre que la normalisation de la calcémie. Le PNDS l’indique noir sur blanc. Un questionnaire spécifique a été développé, le HPQ 28, validé en français avec la participation de patientes de l’association Hypoparathyroïdie France. Il évalue non seulement les symptômes physiques, mais également l’impact sur la vie sociale, affective, sexuelle et professionnelle.
Comment les patients doivent-ils réagir en cas de paresthésies ou de tétanie ?
Dr C. G. : Dès les premiers signes, il faut prendre 1 gramme de calcium avec un grand verre d’eau, toutes les 30 à 45 minutes, jusqu’à amélioration. Il est inutile d’attendre une prise de sang en cas de crise aiguë. Une perfusion de gluconate de calcium peut être nécessaire si les symptômes persistent.
L’éducation thérapeutique peut-elle faire la différence ?
Dr C. G. : L’ETP est fondamentale. Nous avons développé un programme en présentiel à Paris, et un autre existe en visioconférence à Nantes. En trois séances étalées sur quatre semaines, les patients apprennent à interpréter leurs bilans, adapter leurs prises de calcium, comprendre les signaux d’alerte. Les bénéfices sont énormes en termes d’autonomie et de réduction de l’anxiété. Le partage d’expériences entre patient est également très riche.
Quel rôle peuvent jouer les pharmaciens d’officine dans ce parcours ?
Dr. C. G. : Ils sont un maillon clé. Trop souvent, les pharmaciens n’ont pas connaissance de cette pathologie ni des subtilités de la prise en charge. Or, avec l’arrivée prochaine du palopegtériparatide en officine, ils seront directement concernés. Il faut les sensibiliser, leur fournir des outils (vidéos, QR codes, flyers), leur expliquer comment identifier un patient en souffrance ou orienter vers une structure spécialisée. C’est toute une chaîne de soins qu’il faut activer, ensemble.
 Se connecter
Se connecter