Microbiote et santé intestinale : optimiser le conseil et la prise en charge à l'officine
Longtemps relégué au rôle de simple auxiliaire digestif, le microbiote intestinal s'impose aujourd'hui comme un acteur clé de la santé humaine. Immunité, métabolisme, équilibre mental : son influence dépasse largement les frontières du tube digestif. Face aux découvertes récentes, comprendre ses mécanismes et préserver son équilibre devient essentiel. Comment identifier les déséquilibres ? Quels leviers d'action à l'officine ? De l'alimentation aux innovations thérapeutiques, ce dossier explore les enjeux scientifiques et pratiques du microbiote, afin d'intégrer pleinement cette dimension dans la prise en charge officinale.
- 1. Un intérêt grandissant
- 2. Le microbiote intestinal : les bases fondamentales
- a.Qu'est-ce qu'un microbiote ?
- b.Composition et diversité
- 3. Rôles clés dans l'organisme
- a.Digestion et métabolisme des nutriments
- b.Production de vitamines et de métabolites
- c.Modulation du système immunitaire et barrière intestinale
- 4. Facteurs influençant l'équilibre du microbiote
- a.Alimentation
- 1)Rôle des fibres, des prébiotiques et des probiotiques
- 2)Impact des régimes alimentaires
- 3)Mode de vie
- 4)Habitudes quotidiennes
- 5. Médicaments et interventions médicales
- a.Effet des antibiotiques
- b.Impact d'autres traitements
- c.Influence des interventions chirurgicales
- 6. Facteurs génétiques et environnementaux
- a.Héritage familial et transmission précoce
- b.Impact de l'exposition précoce
- 7. Microbiote et axes de santé
- a.Microbiote et santé intestinale
- b.Le rôle de la barrière intestinale
- c.La dysbiose intestinale : un cercle vicieux
- 8. Microbiote et santé mentale (axe intestin-cerveau)
- a.Le concept d'axe intestin-cerveau
- b.Perspectives thérapeutiques
- 9. Microbiote et pathologies dermatologiques
- a.Peau et microbiote
- 10. Microbiote et maladies métaboliques
- a.Microbiote et obésité
- b.Microbiote et diabète
- 11. Orientations pratiques pour la prévention et la prise en charge
- a.Alimentation adaptée
- b.Équilibre macronutriments, micronutriments et fibres
- c.Notions d'aliments fermentés, de prébiotiques et de probiotiques
- 12. Éducation thérapeutique du patient
- a.Sensibiliser aux facteurs qui perturbent le microbiote
- b.Conseils de mode de vie et d'alimentation
- 13. Focus sur les nouveaux traitements
- a.Transplantation de microbiote fécal (TMF)
- b.Innovations en recherche
- c.Perspectives et recherches à venir
- 14. Nouvelles techniques d'analyse
- a.Métagénomique
- b.Métabolomique
- 15. Microbiote et médecine personnalisée
- a.Séquençage du microbiote
- b.Potentiels et limites actuelles
- 16. Axes de recherche émergents
- a.Rôle du microbiote intestinal dans les cancers
- b.Vieillissement en bonne santé
- c.Autres terrains d'exploration
Un intérêt grandissant
Le microbiote intestinal suscite un intérêt scientifique grandissant. Longtemps réduit à son rôle de soutien dans la digestion, il est aujourd’hui considéré comme un véritable « organe » à part entière, influençant non seulement le fonctionnement immunitaire mais aussi l’équilibre mental et métabolique. Les recherches récentes montrent que des déséquilibres dans cet écosystème, appelés « dysbioses », peuvent contribuer au développement de nombreuses pathologies, qu’il s’agisse de troubles digestifs (syndrome de l’intestin irritable, maladies inflammatoires chroniques), de désordres métaboliques (obésité, diabète), ou même de troubles neurologiques et psychiatriques (dépression, anxiété).
Devant l’ampleur de ces découvertes, il devient essentiel de comprendre les mécanismes en jeu et d’agir pour préserver un microbiote en bonne santé. Les professionnels de santé – médecins, pharmaciens, diététiciens, etc. – jouent un rôle clé dans la sensibilisation du public et dans l’accompagnement thérapeutique. Plus que jamais, l’enjeu est d’intégrer la dimension microbiotique dans le suivi des patients pour améliorer leurs perspectives de prévention et de traitement.
Le microbiote intestinal : les bases fondamentales
Qu’est-ce qu’un microbiote ?
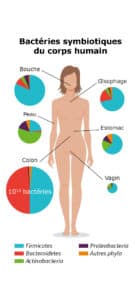
Le terme microbiote désigne l’ensemble des micro-organismes – bactéries, virus, champignons et protozoaires – qui colonisent un environnement spécifique du corps humain, en particulier le tractus digestif. Cette communauté forme un véritable « écosystème microbien », où chaque espèce entretient une relation étroite non seulement avec les autres, mais également avec l’hôte.
Par distinction, le microbiome fait référence à l’ensemble du patrimoine génétique de ces micro-organismes. Ainsi, alors que le microbiote décrit la composition en micro-organismes à un moment donné, le microbiome s’intéresse plutôt à l’expression génomique et à la diversité fonctionnelle de cet écosystème.
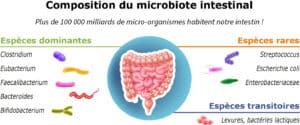
Composition et diversité
Le microbiote intestinal est particulièrement riche et varié, comptant environ 1014 micro-organismes pour un poids total pouvant atteindre 1,5 à 2 kg chez l’adulte. Cette diversité est cruciale pour assurer une multitude de fonctions :
- Bactéries : elles représentent la majorité du microbiote intestinal. Les principaux phylums retrouvés sont les Firmicutes, les Bacteroidetes, les Actinobacteria et les Proteobacteria.
- Virus : le virome intestinal comprend essentiellement des bactériophages, qui régulent la population bactérienne.
- Champignons : plus rares que les bactéries, ils jouent néanmoins un rôle dans l’équilibre microbien (ex. Candida, Saccharomyces).
- Protozoaires : certaines espèces, comme Blastocystis hominis, peuvent coexister sans forcément provoquer de pathologies.
La notion d’équilibre, appelée eubiose, reflète un état où la diversité et la densité des micro-organismes sont harmonieusement réparties, permettant au microbiote d’assurer ses fonctions de manière optimale. Inversement, la dysbiose décrit un déséquilibre qualitatif et quantitatif de ces communautés microbiennes, souvent associé à des états pathologiques tels que l’obésité, le syndrome de l’intestin irritable ou les maladies inflammatoires chroniques de l’intestin (MICI).
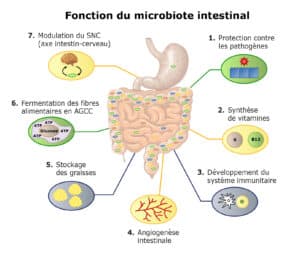
Rôles clés dans l’organisme
Digestion et métabolisme des nutriments
Les bactéries intestinales participent à la dégradation de macronutriments (glucides, protéines, lipides) que notre organisme ne peut pas digérer seul. Par exemple, la fermentation des fibres alimentaires produit des acides gras à chaîne courte (AGCC) tels que l’acétate, le propionate et le butyrate, qui fournissent une source d’énergie à la muqueuse colique et participent à la régulation du métabolisme.
Production de vitamines et de métabolites
Le microbiote synthétise des vitamines essentielles (K, B12, folates, etc.) et divers métabolites. Les AGCC jouent notamment un rôle anti-inflammatoire et contribuent à la régulation du pH intestinal, créant un environnement défavorable à la prolifération de pathogènes.
Modulation du système immunitaire et barrière intestinale
Le microbiote entretient une relation étroite avec le système immunitaire local et systémique. Les micro-organismes interagissent avec les cellules immunitaires de la muqueuse intestinale, contribuant ainsi à la mise en place de la tolérance immunitaire et de la réponse inflammatoire. Par ailleurs, un microbiote équilibré participe au maintien de l’intégrité de la barrière épithéliale, prévenant le passage inapproprié de toxines et de pathogènes dans la circulation sanguine.
Ainsi, le microbiote intestinal ne se limite pas à un simple rôle dans la digestion : il constitue un acteur majeur de la santé humaine, dont l’équilibre (eubiose) se révèle indispensable au bon fonctionnement de l’organisme.
Facteurs influençant l’équilibre du microbiote
Le microbiote intestinal est un écosystème dynamique dont la composition évolue en permanence sous l’influence de multiples facteurs, qu’ils soient alimentaires, médicamenteux, environnementaux ou génétiques. Comprendre ces mécanismes est essentiel pour mettre en place une stratégie de préservation et de restauration de l’équilibre microbien.
Alimentation
Rôle des fibres, des prébiotiques et des probiotiques
- Fibres alimentaires : les fibres solubles (par exemple pectines, ß-glucanes) sont fermentées par les bactéries intestinales et génèrent des AGCC bénéfiques pour l’intégrité de la muqueuse et la régulation immunitaire. Les fibres insolubles (cellulose) favorisent le transit et limitent la stagnation de résidus dans le côlon.
- Prébiotiques : ils correspondent à des substrats spécifiques (ex. fructo-oligosaccharides, inuline) que seules certaines bactéries du microbiote peuvent métaboliser, stimulant ainsi sélectivement leur croissance. Les prébiotiques améliorent la diversité microbienne et participent à l’eubiose.
- Probiotiques : ces souches bactériennes vivantes (ex. Lactobacillus, Bifidobacterium) ou levures (Saccharomyces boulardii) confèrent un bénéfice santé lorsqu’elles sont administrées en quantité adéquate. Elles peuvent renforcer la barrière intestinale, moduler l’immunité, et limiter la prolifération d’agents pathogènes.
Impact des régimes alimentaires
- Régime végétarien : souvent riche en fibres, ce qui favorise la croissance de bactéries productrices d’AGCC et l’apparition d’un profil microbien globalement plus diversifié.
- Régime occidental : généralement élevé en sucres raffinés, graisses saturées et pauvre en fibres, il peut générer une dysbiose propice à l’inflammation, à la résistance à l’insuline et au surpoids.
- Régime méditerranéen : caractérisé par une forte consommation de fruits, légumes, céréales complètes, légumineuses, poissons gras et huile d’olive, il apparaît bénéfique pour l’équilibre microbien. Les études montrent une meilleure diversité bactérienne et une diminution des marqueurs inflammatoires.
Mode de vie
Le stress chronique, en altérant l’axe intestin-cerveau (via le système nerveux autonome et l’axe hypothalamo-hypophyso-surrénalien), peut modifier durablement la composition microbienne et favoriser une hyperperméabilité ainsi qu’une hypersensibilité intestinale. De la même manière, le manque de sommeil perturbe le rythme circadien, affecte la sécrétion hormonale (cortisol, mélatonine) et modifie la motricité digestive, ce qui peut également conduire à une dysbiose.
À l’inverse, une activité physique régulière et modérée contribue à enrichir la diversité du microbiote et à soutenir la production d’acides gras à chaîne courte, tandis que la sédentarité ou le surentraînement tendent à déséquilibrer l’écosystème intestinal.
Habitudes quotidiennes
- Hygiène : une hygiène excessive, liée par exemple à la surutilisation de produits antiseptiques, peut appauvrir la diversité microbienne en éliminant des bactéries commensales essentielles.
- Surconsommation de produits antibactériens : outre l’impact direct sur la flore cutanée et respiratoire, elle peut également influencer le microbiote intestinal à travers l’absorption de résidus chimiques et la réduction de la diversité microbienne globale.
Médicaments et interventions médicales
Effet des antibiotiques
L’administration d’antibiotiques, surtout à large spectre, constitue une des principales causes de dysbiose. Les antibiothérapies répétées ou de longue durée favorisent la disparition de certaines souches protectrices et la surcroissance de pathogènes comme Clostridioides difficile. Après une cure d’antibiotiques, la reconstitution du microbiote peut prendre plusieurs semaines, voire plusieurs mois, et ne se fait pas toujours à l’identique de l’état initial.
Impact d’autres traitements
- IPP : en modifiant le pH gastrique, ils perturbent la première barrière d’inactivation des bactéries exogènes, favorisant leur passage dans le tractus intestinal et pouvant engendrer un déséquilibre microbien.
- Anti-inflammatoires : certains AINS altèrent la muqueuse gastro-intestinale et peuvent exacerber des phénomènes inflammatoires locaux, modifiant indirectement la flore.
- Corticostéroïdes : leur effet immunosuppresseur peut aussi avoir un impact sur la répartition des espèces microbiennes.
Influence des interventions chirurgicales
La chirurgie bariatrique, en provoquant des modifications anatomiques et physiologiques telles que la réduction de la surface d’absorption, l’accélération du transit et des changements hormonaux significatifs, entraîne une réorganisation importante du microbiote intestinal. Si cette transformation peut contribuer à une meilleure gestion pondérale, elle expose également le patient à un risque accru de carences nutritionnelles et de désordres digestifs, témoignant de l’impact complexe de l’intervention sur l’équilibre microbien.
Facteurs génétiques et environnementaux
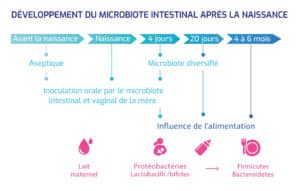
Héritage familial et transmission précoce
Le microbiote s’acquiert dès la grossesse et continue à se façonner lors de l’accouchement et des premiers mois de vie. Le type d’accouchement (voie basse vs césarienne) influe sur la composition initiale de la flore, de même que l’alimentation (allaitement maternel vs lait infantile).
Des similitudes entre membres d’une même famille témoignent de l’influence génétique et environnementale commune.
Impact de l’exposition précoce
- Accouchement par voie basse vs césarienne : lors d’un accouchement par voie basse, le nouveau-né est exposé au microbiote vaginal et digestif maternel, favorisant une colonisation précoce par des bactéries bénéfiques, notamment des lactobacilles et des bifidobactéries, essentielles au développement du microbiote intestinal et du système immunitaire. En revanche, la naissance par césarienne limite cette transmission et entraîne une colonisation initiale dominée par des bactéries cutanées (Staphylococcus, Corynebacterium) et environnementales, ce qui pourrait influencer le développement immunitaire et le risque ultérieur de certaines pathologies, comme les allergies ou l’obésité.
- Allaitement vs lait maternisé : le lait maternel constitue une source unique de nutriments et de composés bioactifs essentiels au développement du microbiote intestinal et du système immunitaire du nourrisson. Il contient non seulement des bactéries commensales bénéfiques (notamment Bifidobacterium et Lactobacillus), mais aussi des oligosaccharides spécifiques (HMO, « human milk oligosaccharides ») jouant un rôle prébiotique en favorisant la croissance de bactéries protectrices et en modulant l’immunité. Bien que les laits infantiles soient enrichis en prébiotiques et parfois en probiotiques, leur composition ne peut reproduire la diversité et la synergie des composants immunomodulateurs et microbiotiques du lait maternel.
Ainsi, l’équilibre du microbiote repose sur des facteurs multiples, allant de l’alimentation au mode de vie, en passant par les traitements médicaux et le contexte génétique. Agir sur ces différents paramètres permet de prévenir ou de limiter les dysbioses et d’optimiser la santé intestinale dans une approche de santé globale.
Microbiote et axes de santé
Microbiote et santé intestinale
Le microbiote intestinal joue un rôle déterminant dans le maintien de la santé digestive. Au-delà de sa fonction métabolique, il interagit étroitement avec la barrière intestinale et le système immunitaire, influençant l’apparition ou l’aggravation de pathologies digestives telles que le syndrome de l’intestin irritable (SII), la maladie de Crohn ou la rectocolite hémorragique (RCH).
Le rôle de la barrière intestinale
La barrière intestinale repose sur plusieurs éléments essentiels : les jonctions serrées entre les entérocytes, la couche de mucus protégeant l’épithélium, ainsi que la flore microbienne elle-même. Lorsque cette barrière est altérée, le phénomène d’hyperperméabilité – également appelé « leaky gut » – permet à des antigènes d’origine alimentaire ou microbienne de traverser la muqueuse. Ce passage inapproprié de molécules dans la circulation sanguine peut activer une réponse inflammatoire systémique et aggraver des troubles digestifs déjà existants.
Des études montrent que ce mécanisme est impliqué dans le SII, où l’hypersensibilité viscérale et les perturbations inflammatoires entretiennent douleurs et inconforts. Dans le cas des MICI, comme la maladie de Crohn et la rectocolite hémorragique, l’altération de la barrière et la dysbiose microbienne instaurent un cercle vicieux pro-inflammatoire qui contribue à la chronicité et à la sévérité des symptômes.
La dysbiose intestinale : un cercle vicieux
La dysbiose se caractérise par une perte de diversité ou un déséquilibre entre bactéries bénéfiques et potentiellement pathogènes. Parmi les facteurs déclencheurs, on retrouve l’alimentation pauvre en fibres ou trop riche en sucres et en graisses saturées, la prise répétée d’antibiotiques, le stress ou encore un mode de vie sédentaire. Une fois installée, la dysbiose peut favoriser l’inflammation locale et systémique, la perméabilité intestinale et même influencer le métabolisme, contribuant ainsi à l’apparition ou à l’aggravation de diverses pathologies digestives et extra-digestives.
Pour rééquilibrer le microbiote, plusieurs approches complémentaires sont généralement préconisées. L’amélioration de l’hygiène de vie (alimentation variée et riche en fibres, activité physique régulière, gestion du stress) constitue un pilier fondamental. L’utilisation de probiotiques et de prébiotiques vise à réintroduire ou à favoriser la croissance de souches bénéfiques, tandis que certaines stratégies nutritionnelles (régime pauvre en FODMAPs dans le cadre du SII, par exemple) peuvent être mises en place pour soulager les symptômes. Enfin, un suivi médical personnalisé, incluant éventuellement des traitements immunomodulateurs ou anti-inflammatoires, reste indispensable dans les formes sévères, notamment pour les MICI.
Microbiote et santé mentale (axe intestin-cerveau)
Le concept d’axe intestin-cerveau
Depuis quelques années, l’attention portée à l’axe intestin-cerveau s’est intensifiée, révélant une communication bidirectionnelle complexe entre le système nerveux central et le tractus digestif. Plusieurs voies de signalisation sont impliquées :
- Nerf vague : principal canal de transmission de messages entre l’intestin et le cerveau, il transmet des informations sur l’état de la muqueuse et la composition microbienne.
- Système immunitaire : les interactions entre le microbiote et les cellules immunitaires intestinales participent à la modulation des cytokines et autres médiateurs inflammatoires, capables d’influencer le fonctionnement cérébral.
- Métabolites microbiens : les bactéries intestinales produisent des substances telles que les AGCC, les acides aminés ou encore certains neuromédiateurs (sérotonine, GABA) susceptibles de traverser partiellement la barrière hémato-encéphalique ou d’agir via le système immunitaire.
Plusieurs études ont mis en évidence le lien entre dysbiose et troubles psychiques ou neurodégénératifs. L’anxiété et la dépression, par exemple, peuvent être aggravées par une production anormale de certains métabolites (toxines, cytokines pro-inflammatoires) et par la perturbation du dialogue neuro-immun. De plus, des recherches suggèrent une éventuelle influence du microbiote sur la progression de maladies comme la maladie de Parkinson ou d’Alzheimer, même si les mécanismes exacts restent à préciser.
Perspectives thérapeutiques
Dans ce contexte, le concept de « psychobiotiques » a émergé. Il regroupe les souches probiotiques et prébiotiques qui, en modulant positivement l’équilibre microbien, peuvent avoir un effet bénéfique sur l’humeur et l’anxiété. Des essais cliniques préliminaires suggèrent qu’une supplémentation ciblée (par exemple en Lactobacillus et Bifidobacterium) pourrait réduire la réponse au stress et améliorer certains paramètres de la dépression ou de l’anxiété.
Par ailleurs, un changement alimentaire privilégiant des fibres prébiotiques (fruits, légumes, céréales complètes) et limitant les aliments ultratransformés peut soutenir la diversité microbienne, réduire l’inflammation et contribuer ainsi à l’équilibre émotionnel. La prise en charge globale inclut également la gestion du stress (techniques de relaxation, méditation) et l’activité physique, tous deux susceptibles de moduler l’axe intestin-cerveau.
Microbiote et pathologies dermatologiques
Peau et microbiote
La peau possède son propre microbiote cutané, constitué de bactéries, de virus et de champignons, dont la diversité et la répartition varient selon les zones corporelles (séborrhéiques, humides, sèches). Bien que distinct, ce microbiote entretient des interactions complexes avec le microbiote intestinal via divers médiateurs immunitaires et inflammatoires, formant ce que l’on appelle parfois « l’axe intestin-peau ». Ainsi, une dysbiose intestinale peut influencer la réponse cutanée, tandis qu’une inflammation locale ou systémique peut modifier la composition du microbiote cutané.
Dans le cadre de certaines pathologies inflammatoires telles que l’eczéma atopique, l’acné ou le psoriasis, ce déséquilibre microbien intestinal (dysbiose) peut exacerber, voire maintenir l’atteinte dermatologique. Des études suggèrent qu’une restauration de l’équilibre microbien par l’alimentation ou l’utilisation de probiotiques pourrait améliorer ces troubles cutanés. Par exemple, Bowe et Logan (Gut Pathogens, 2011) ont décrit le concept du « gut-brain-skin axis », mettant en évidence l’influence des altérations de la flore intestinale sur l’inflammation systémique et la fonction barrière de la peau, notamment dans l’acné.
Microbiote et maladies métaboliques
Microbiote et obésité
De nombreuses recherches ont mis en évidence des différences notables dans la composition du microbiote intestinal chez les personnes obèses par rapport aux individus de poids normal, notamment en ce qui concerne le ratio Firmicutes/Bacteroidetes. Parmi les études marquantes, les travaux de Turnbaugh et al. (Nature, 2006) ont clairement illustré le rôle d’un microbiome « obésogène » présentant une capacité accrue à extraire l’énergie de la ration alimentaire. En outre, un excès de certaines bactéries peut favoriser la synthèse de métabolites pro-inflammatoires, contribuant ainsi à la prise de poids et au stockage des graisses.
Dès lors, la modulation de la flore intestinale par l’alimentation (fibres prébiotiques, aliments fermentés) et l’utilisation de probiotiques spécifiques constitue une piste thérapeutique ou préventive pour l’obésité. Par exemple, une étude réalisée par Kadooka et al. (British Journal of Nutrition, 2013) a montré qu’une supplémentation en Lactobacillus gasseri pouvait réduire la masse grasse viscérale chez des adultes en surpoids, tout en atténuant les marqueurs inflammatoires. On retrouve cette souche notamment dans Classeri® des laboratoire Aragan, formulé avec du camu-camu et de vitamine C, pour un effet stimulant.
Microbiote et diabète
Le diabète de type II est marqué par une résistance à l’insuline et une hyperglycémie chronique, fréquemment associées à une dysbiose intestinale. Les travaux de Qin et al. (2012) publiés dans Nature ont notamment mis en évidence des altérations significatives de la composition et de la diversité du microbiote chez les patients diabétiques par rapport aux sujets sains. Ce déséquilibre microbien contribue à l’altération de la barrière intestinale et à l’inflammation de bas grade, deux facteurs qui amplifient la résistance à l’insuline. Par ailleurs, les modifications dans la production d’acides gras à chaîne courte et d’autres métabolites bactériens impactent directement le métabolisme glucidique et lipidique.
Sur le plan thérapeutique, l’optimisation du microbiote apparaît comme une piste prometteuse pour améliorer la sensibilité à l’insuline. L’administration de prébiotiques et de probiotiques, en favorisant la diversité et la richesse bactérienne, pourrait ainsi limiter la réponse inflammatoire et contribuer à un meilleur contrôle glycémique.
Orientations pratiques pour la prévention et la prise en charge
Pour prendre en charge efficacement ces affections, il convient d’adopter une approche globale :
- Alimentation et probiotiques : un régime riche en fibres et en micronutriments soutient la diversité du microbiote. Les probiotiques oraux (ex. Lactobacillus, Bifidobacterium) peuvent contribuer à réduire l’inflammation systémique. Par ailleurs, certains produits topiques à base de probiotiques s’avèrent prometteurs pour restaurer le film hydrolipidique et réguler la flore cutanée.
- Gestion du stress et du sommeil : les perturbations neuro-hormonales liées au stress chronique ou au manque de sommeil aggravent l’inflammation locale et contribuent à la dysbiose. Des pratiques de relaxation et une hygiène de sommeil optimale peuvent donc améliorer à la fois l’équilibre microbien et la qualité de la peau.
Alimentation adaptée
L’alimentation constitue l’un des piliers fondamentaux du maintien et de la restauration d’un équilibre microbien optimal.
Équilibre macronutriments, micronutriments et fibres
L’apport adéquat en protéines, lipides et glucides, associé à une consommation régulière de fruits, légumes et céréales complètes, garantit un spectre de nutriments indispensables à la diversification du microbiote. Les fibres alimentaires, qu’elles soient solubles ou insolubles, participent à la fermentation colique et à la production d’AGCC, fondamentaux pour l’intégrité de la muqueuse intestinale et la modulation de la réponse immunitaire.
Les apports en micronutriments (vitamines, minéraux) soutiennent également la santé intestinale en participant à diverses fonctions métaboliques, antioxydantes et immunitaires.
Notions d’aliments fermentés, de prébiotiques et de probiotiques
- Aliments fermentés : yogourt, kéfir ou choucroute sont riches en bactéries lactiques naturelles. Leur consommation régulière contribue à enrichir la diversité microbienne et à soutenir l’équilibre global du microbiote.
- Prébiotiques : il s’agit de substrats non digestibles (ex. inuline, fructo-oligosaccharides) qui favorisent sélectivement la croissance de certaines bactéries bénéfiques, notamment des Bifidobacterium et des Lactobacillus. Les prébiotiques se retrouvent dans les légumes racines (topinambours, artichauts), les bananes vertes et les céréales complètes, entre autres.
- Probiotiques : les souches probiotiques (ex. Lactobacillus rhamnosus GG, Bifidobacterium longum) peuvent renforcer la barrière intestinale, moduler l’immunité et concurrencer les bactéries pathogènes. En pratique, elles sont proposées sous forme de compléments alimentaires, à l’image de Ergyphilus® Plus de Nutergia.
Éducation thérapeutique du patient
Le pharmacien joue un rôle clé dans l’éducation thérapeutique en orientant le patient vers une prise en charge adaptée de son microbiote. Cette approche suppose une sélection réfléchie des souches probiotiques en fonction du contexte clinique : ainsi, pour les personnes souffrant du syndrome de l’intestin irritable, l’utilisation de Bifidobacterium longum 35624® (présent notamment dans Symbiosis Alflorex®) s’avère particulièrement recommandée afin de soulager les symptômes. De même, en cas de diarrhée associée à une antibiothérapie, une souche comme Saccharomyces boulardii, contenu par exemple dans Ultra-Levure®, est fréquemment préconisée pour rétablir l’équilibre microbien et réduire le risque de récidive.
Sensibiliser aux facteurs qui perturbent le microbiote
Le stress chronique, la sédentarité, l’alcool ou la consommation régulière d’aliments ultra-transformés font partie des perturbateurs majeurs de l’équilibre microbien.
Expliquer au patient le rôle néfaste de ces facteurs, ainsi que les mécanismes en jeu, permet de renforcer sa motivation à modifier durablement son mode de vie.
Conseils de mode de vie et d’alimentation
Un programme réaliste et personnalisé inclut la mise en place d’une activité physique adaptée, la gestion du stress (relaxation, méditation, etc.) et l’équilibre du rythme veille-sommeil. Sur le plan alimentaire, la priorité est donnée aux aliments bruts, riches en fibres, et à une limitation des sucres rapides, des graisses saturées et de l’alcool.
Focus sur les nouveaux traitements
Si l’alimentation et l’hygiène de vie constituent la base de la prévention et du traitement de la dysbiose, d’autres approches plus novatrices font l’objet de recherches actives et d’applications cliniques ciblées.
Transplantation de microbiote fécal (TMF)
La transplantation de microbiote fécal consiste à transférer la flore intestinale d’un donneur sain vers un patient souffrant d’une dysbiose sévère ou résistante aux traitements conventionnels (ex. infections récurrentes à Clostridioides difficile).
Les résultats se révèlent très prometteurs dans certaines indications validées, et des pistes d’extension thérapeutique se dessinent pour des affections métaboliques, immunitaires ou neuropsychiatriques, bien que des études supplémentaires soient nécessaires pour confirmer son efficacité et sa sécurité à long terme.
Innovations en recherche
Les postbiotiques, issus du métabolisme des micro-organismes, suscitent un intérêt grandissant. Il s’agit notamment d’enzymes, de peptides antimicrobiens, ou d’acides gras à chaîne courte, susceptibles de reproduire certains effets bénéfiques des souches vivantes sans les contraintes de stabilité ou de conservation associées. Les combinaisons de souches probiotiques spécifiques (multi-souches) font l’objet d’essais cliniques visant à déterminer le protocole optimal (dose, durée, association avec prébiotiques).
À plus long terme, la médecine personnalisée du microbiote pourrait se développer grâce aux progrès en séquençage métagénomique, permettant d’identifier précisément les déséquilibres et d’élaborer des traitements ciblés pour chaque individu.
Perspectives et recherches à venir
Alors que la connaissance du microbiote intestinal s’est considérablement étendue au cours de la dernière décennie, les avancées technologiques ouvrent la voie à des applications cliniques encore plus pointues. De la métagénomique à la médecine personnalisée, les chercheurs explorent de nouvelles pistes pour affiner notre compréhension et améliorer la prise en charge des déséquilibres microbiens.
Nouvelles techniques d’analyse
Métagénomique
Les méthodes de séquençage à haut débit (« next-generation sequencing ») permettent d’analyser l’ensemble des gènes présents au sein d’un échantillon microbien, offrant ainsi une cartographie extrêmement détaillée des espèces bactériennes, virales, fongiques et protozoaires en présence. Cette approche révolutionne notre compréhension du microbiote en identifiant non seulement les taxons dominants, mais aussi les espèces rares qui peuvent jouer un rôle clé dans la régulation immunitaire ou métabolique.
Métabolomique
Au-delà de l’identification des espèces, l’étude des métabolites produits par ces micro-organismes (acides gras à chaîne courte, acides aminés, vitamines, etc.) permet d’évaluer leur impact fonctionnel sur l’organisme. Grâce à des techniques d’analyses de pointe (spectrométrie de masse, résonance magnétique nucléaire), les chercheurs peuvent explorer les interactions métaboliques complexes entre l’hôte et son microbiote.
Ces innovations offrent une vision plus fine et plus dynamique de la flore intestinale, ouvrant la porte à la compréhension des mécanismes sous-jacents aux dysbioses et à leurs conséquences sur la santé.
Microbiote et médecine personnalisée
Séquençage du microbiote
Les progrès de la métagénomique laissent entrevoir la possibilité de réaliser, en routine, des profils microbiens individualisés. À partir de ces données, il pourrait devenir envisageable de proposer des recommandations diététiques ou thérapeutiques ultra-ciblées, adaptées au profil exact de chaque patient. Des start-up et laboratoires s’intéressent déjà à l’élaboration de kits de diagnostic destinés à la médecine de ville, même si leur utilisation reste encore limitée.
Potentiels et limites actuelles
La personnalisation des interventions (probiotiques, prébiotiques, transplantation de microbiote fécal) est un horizon prometteur, mais de nombreux paramètres (facteurs génétiques, environnementaux, habitudes de vie) demeurent difficiles à contrôler. De plus, la standardisation des méthodologies d’analyse et l’interprétation des résultats constituent encore des défis importants. Malgré ces limites, l’émergence d’une véritable « médecine de précision » centrée sur le microbiote est déjà amorcée dans certaines spécialités.
Axes de recherche émergents
Rôle du microbiote intestinal dans les cancers
Plusieurs études suggèrent une influence du microbiote sur la carcinogenèse, notamment via la modulation de l’inflammation et la production de métabolites pro- ou anti-tumoraux. De plus, certaines équipes investiguent l’impact de la composition microbienne sur la réponse aux traitements anticancéreux (immunothérapies, chimiothérapies).
Vieillissement en bonne santé
Avec l’allongement de l’espérance de vie, la préservation d’un microbiote diversifié et équilibré pourrait constituer un levier de prévention du déclin immunitaire et cognitif lié à l’âge. Des recherches se penchent sur la possibilité d’optimiser la flore des personnes âgées afin de limiter la fragilité, l’inflammation chronique et la détérioration des fonctions métaboliques.
Autres terrains d’exploration
Les liens entre microbiote intestinal et allergies, maladies auto-immunes, santé osseuse ou encore performance sportive suscitent un intérêt croissant. L’étude de la variation de la flore en fonction de différents contextes (pollution, régimes extrêmes, zones de haute altitude, etc.) vient compléter ce tableau particulièrement dynamique.