Nouveau Règlement européen pour les DM
Le nouveau règlement européen sur les dispositifs médicaux est entré en vigueur le 26 mai 2021. Il renforce les exigences pour leur commercialisation et harmonise les normes européennes. Les pharmaciens doivent procéder à différentes vérifications avant commercialisation.
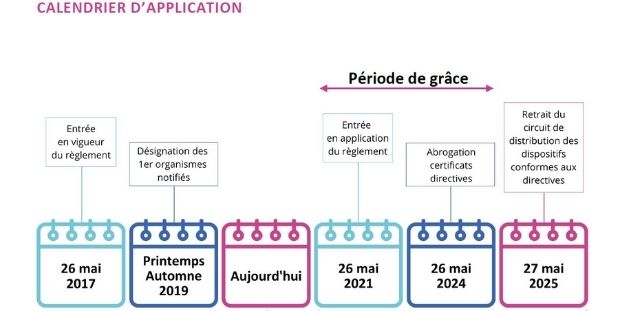
Toutes les étapes-clés du parcours d’un dispositif médical (DM) sont renforcées par le nouveau règlement européen 2017/745 modifié par le règlement 2020/561.Après un report d’un an en raison de la crise sanitaire liée au Covid-19, il s’applique depuis le 26 mai 2021. Et le champ d’application est large puisque les DM vont de la béquille à l’implant en passant par les orthèses, les préservatifs, les pansements, les fauteuils roulants et même certaines crèmes à fonction barrière. Les probiotiques (produits qui contiennent des substances ou produits biologiques) sont désormais exclus du statut de DM. En revanche, s’y intègrent des produits à visée non médicale comme des lentilles colorées, des produits de comblement des rides ou des lasers d’épilation.
Le principe du marquage CE médical est conservé mais avec des exigences accrues concernant le cahier des charges, l’évaluation clinique et la surveillance après mise sur le marché. Cela...
Ce contenu est réservé aux utilisateurs inscrits sur le site pharma365
Déjà abonné ? Connectez-vous